Anyagi Halmazok, Kémiai Kötések
A sok részecskékből álló anyagokat, anyagi halmazoknak nevezzük, amelyeknek kémiában mértékegysége is van. Ez a mértékegység, lesz az anyagmennyiség, amelynek a jele n. Mértékegysége a mol, amiről ugye már esett szó. Egy mol bármilyen részecske, hatszor, tíz a huszonharmadikon-on db részecskét jelent. Még bevezetésképpen, megemlíthető a tömegmegmaradás törvénye, amely kimondja azt, hogy a kémiai reakciókban szereplő kiindulási anyagok, valamint a termékek tömegének, egyenlőnek kell lennie. Ezt az egyenlővé tételt, az egyenlet rendezéssel fogjuk megtenni.
- Anyagi Halmazok Csoportosítása
Először is beszélhetünk, az egy komponensű anyagokról, vagy kémialiag tiszta anyagokról, amelyeknek két altípusa van. Ezek az elemek, pl. O2, H2 valamint a vegyületek pl. a H2O. A kémiailag tiszta anyagokról, azt kell tudni, hogy az adott halmazban, csak egy féle anyag van.
A fázisok, a rendszer jól meghatározhatóan elkülönülő részeit jelentik.
A keverékek, több komponensű, egy vagy több fázisú rendszerek lehetnek.
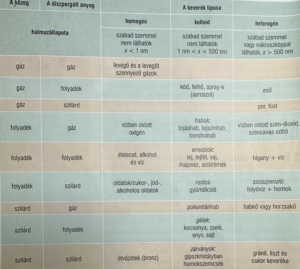
A diszperz rendszerek, olyan rendszerek, amelyekben az egyik anyag, a másikban szét van valamilyen formában oszlatva.
Nem szabad elmennünk még, az elegyek mellett sem, amelyek olyan rendszerek, ahol két különböző anyag van egymással elkeverve, azonban egy fázisban vannak jelen, ellentétben a diszperz rendszerekkel, ahol több fázis volt jelen.
Szintén nagyon szorosan kapcsolódik ide a homogén valamit a heterogén rendszerek fogalma. A homogén rendszerek, azok ránézve csak egyféle anyagból állnak, vagy legalábbis nem különíthetőek el egymástól, a különböző anyagok. Pl. egy por keverék
A heterogén rendszerek esetén, mindig látható egy határ felület, a két anyag között, tehát lényegében fázisok láthatóak.
A rendszerek, egy speciális típusa, a kolloid rendszer, amely rendszer egy speciális mérettartományú részecskékre utal. Ez a mérettartomány pedig 1-500 nm ig tartó méretet jelent.
A kolloidok típusairól, is érdemes itt egy pár szót említeni, méghozzá beszéltünk eukolloidokról és asszociációs kolloidokról. Az eukolloidok, ténylegesen adott részecskeméretet tekintve, is a kolloid mérettartományba esnek. Az asszociációs kolloidok, pedig kisebb molekulák összeállásából keletkeznek. A kolloidok egy jellemző tulajdonsága még, az adszorpciós képesség, ami azt jelenti, hogy felületükön, különböző anyagokat képesek megkötni a nagy fajlagos felület miatt.
Tovább haladva, beszélhetünk úgynevezett diszpergált anyagokról. A diszpergálás, az oszlatást jelent, vagyis valamilyen anyagot eloszlatunk egy valamely másik anyagban. Az az anyag, amelyben eloszlattuk a diszpergált részecskéket, azt közegnek hívjuk.
- Kémiai kötések
A kémiai kötések közül, egyről már beszéltünk, meghozzá a Kovalens kötésről. Most megfogjuk nézni, a többi, elsőrendű kötéseket.
Az elsőrendű kötések, a molekulákban találhatóak, tehát a molekulákat összetartó kötéseket értjük ezalatt. Ezen elsődleges kötések, erősebbek lesznek, mint a másodlagos kötések, amelyekről mindjárt fogunk beszélni.
Elsődleges Kötések
A Kovalens kötésről már sok mindent tudunk, amit itt újra megemlítenék, hogy párosítatlan elektron párok segítségével létrejövő kötést jelent. Alapvetően, kialakulásának a feltétele, hogy viszonylag nagy elektronegativitású atomok legyenek az alkotók.
Az elsőrendű kötések következő típusa, az ion kötés. Ionkötés esetén, egy elektrosztatikus vonzerőről beszélünk, amely a negatív és a pozitív töltésű ionok között alakulhatnak ki. Kialakulásának feltétele, a nagy elektronegatívitás különbség, az atomok között.
Fémes kötés. A fémes kötés, mint neve is elárulja fém atom törzsek között jön létre. Összetartó ereje, a delokalizált elektronrendszer. Kialakulásának feltétele, a kis elektronegativitás különbség, valamint a fémes jelleg.
Fontos, hogy beszélhetünk különböző átmenetekről, pl. a kovalens kötés is, ionos jelleget vehet fel a molekula polarizációja esetén. A lényeg az az, hogy átmenetekben gondolkodjunk.
Az olvadás és forráspontokat tekintve, a kovalens kötésű molekulák, azok alacsony olvadás, forráspontúak lesznek.
Az ionos, valamint a fémes kötés, pedig magas olvadás és forráspontot jelent.
- Másodlagos Kötések
A másodlagos kötések, azok intermolekulárisan alakulnak ki, tehát molekulák között. Ezért nem is tényleges kötések, inkább kölcsönhatások.
A legerősebb ilyen kölcsönhatás, a hidrogén kötés, amely, mint neve is mutatja, egy hidrogén segítségével alakul ki, két molekula között. Kialakulásának a feltétele, a hidrogén jelenléte, valamint az a tény, hogy a hidrogénnek, nagy elektronegatívitású, nemkötő elektron párral rendelkező atomhoz kell, kapcsolódnia, pl. oxigén atom.
A dipólus-dipólus kölcsönhatás esetén, a poláris anyagok közti elektromos vonzerőt kell érteni. Erőssége, jóval kisebb, mint a hidrogénkötésnek, azonban nagyobb, mint a másik másodlagos kölcsönhatásnak. Az ilyen kötések csak poláris anyagok között jönnek létre.
A diszperziós kölcsönhatás, az pillanatnyi töltéseltolódáson alapuló, apoláris anyagok között létrejövő gyenge vonzerő. Ezen anyagok, alacsony olvadás és forráspontúak.
A hidrogén kötést kialakító vegyületek, általában magasabb olvadás és forráspontúak lesznek mint.
Ebből is látható, az olvadás, illetve Forráspont az attól függ, hogy az atomok, illetve a molekulák milyen erős kötést, illetve kölcsönhatást alakítanak ki egymással.
Itt érdemes megemlíteni, a hasonló hasonlóban oldódik elvet, amely már említésre került, és azt mondja ki, hogy apoláris anyag, apoláros anyagban oldódik, poláris pedig poláris anyagban. Ez azért van így, mert apoláris anyaggal csak apoláris anyag tud megfelelő kölcsönhatást kialakítani.