A periódusos rendszer, ionok képződése
- A periódusos rendszer tulajdonságai
A periódusos rendszer a kémiában való tájékozódás “térképe”, ezért nagyon fontos minden részletének ismerete, azonban ezek szerencsére könnyen megjegyezhető információk.
Mindenképpen ajánlott minél részletesebb periódusos rendszert beszerezni az érettségire, ami a függvénytáblázatokban van, azok megfelelőek szoktak lenni.
Mi mit jelöl egy periódusos rendszerben?
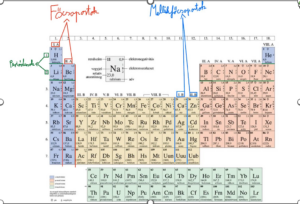
A fent látható helyen jelöljük egy atom rendszámát, ami egy atom, periódusos rendszerben való elhelyezkedését adja meg, valamint a szerkezetére vonatkozó információkkal is szolgáltat. (lsd: 1. lecke)
Egy atom tömegszáma általában az adott atom alatt látható a periódusos rendszerben, és amellett, hogy segítségével a neutronszám kiszámolható, az adott atom moláris tömegét is megadja
A moláris tömeg, egy atom vagy egy molekula egy móljának a tömegét adja meg.
A mól, vagy másnéven anyagmennyiség, (jelölése: n) a kémiában legfontosabb mértékegység, kb úgy képzeljük el, hogy egy olyan egység, amely 6*10^23 db részecskét tartalmaz. És ez a darabszámú részecske, minden atom, és molekula esetén más-más tömeget nyom, amelyet a fent említett moláris tömeg jellemez.
A periódusos rendszerben fontos megkülönböztetnünk a főcsoportokat, amelyek tágabb értelemben az oszlopok lesznek, és fontosak olyan szempontból, hogy megadják egy főcsoportban található atomok vegyértékelektronszámát. Például az első főcsoportban található atomoknak mind-mind 1-1 lesz a vegyértékelektronszáma.
A másik fontos megkülönböztetendő szabály a periódusos rendszerben, a sorok, vagyis a periódusok, amelyek szintén következtetnek az elektronszerkezetre, méghozzá olyan módon, hogy egy periódus megadja a vegyértékelektronhéj számát. Például, az első periódusban található atomok utolsó héjának, –tehát a vegyértékelektronhéj- száma, 1.
- Periodikusan változó tulajdonságok
A periodikusan változó tulajdonságok, fontosak lesznek később szervetlen kémián, valamint kell tudni elméleti szinten a fogalmakat is, hiszen előfordulnak kivétel nélkül mindig érettségin!
A legfontosabb ilyen tulajdonságok:
- Elektronegativitás: Lényegében egy atom elektronvonzó képességét jellemző dimenzió nélküli szám.
- Periodikus váltakozása: Egy perióduson belül balról jobbra haladva nő, egy főcsoporton belül felülről lefelé haladva csökken!
- Első ionizációs energia: Egy szabadállapotú atomlegkönnyebben leszakítható elektronjának eltávolításához szükséges energiamennyiség.
- Periodikus váltakozása: Egy perióduson belül balról jobbra haladva nő, egy főcsoporton belül felülről lefelé haladva csökken!
- Elektronaffinitás: Egy szabadállapotú atomból, egyszeres ion képzőse során felszabadult, vagy elnyelődött energiamennyiség.
- Periodikus váltakozása: Egy perióduson belül balról jobbra haladva nő, egy főcsoporton belül felülről lefelé haladva csökken!
- Atomsugár: Egy atom nagyságára, átmérőjére vonatkozó mértékegység (az átmérő fele).
- Periodikus váltakozása: Egy perióduson belül balról jobbra haladva csökken, egy főcsoporton belül felülről lefelé haladva nő!
- Ionok képződése
Előszőr is tisztázzuk, hogy mik azok az ionok. Az ionok töltéssel rendelkező részecskék, amelyek típus szerint mutatnak eltérést. A fő típusaik: Egyszerű, Összetett, Komplex ionok. A típusokról részletesebben később még fogunk beszélni. Az ionokat alapvetően töltésük szerint is tudjuk csoportosítani, mégpedig eszerint beszélhetünk pozitív töltésű /kationok/-ról, valamint negatív töltésű, /anionok/-ról.
Most akkor nézzük meg hogy hogyan is képződnek az ionok, és miért.
A periódusos rendszerben látható alapállapotú atomok, alapvetően egy energetikailag nem kedvező állapotban vannak jelen. Ahhoz, hogy egy kedvezőbb energiaszintre kerüljenek, kénytelen elérni a nemesgáz szerkezetet, vagyis azt a szerkezetet, amelynél az elektronhéj telített állapotában van jelen.
A nemesgáz szerkezet elérést két féle módon tudja megoldani az atom, egyrészt ionná alakulással, amiről most fogunk beszélni, másrészt pedig molekulaképződéssel, amelyről majd pedig később.
Ionná alakulás történhet elektron leadással, valamint elektron felvétellel is. Fontos, hogy nem csak egy elektront vehet fel, illetve adhat le egy atom, hanem többet. Azok az atomok, amelyek elektronleadással érték el a nemesgáz szerkezetet, azok pozitív töltésű ionok, vagyis kationok lesznek. Azért lesz pozitív a töltés, mert egy (vagy több) negatív töltésű részecskével kevesebb lett az atomban, hiszen azt leadta, így a pozitív töltés került túlsúlyba. Azon atomokat, amelyek elektronfelvétellel érték el a nemesgáz szerkezetet, negatív töltésű ionoknak, vagyis anionoknak hívjuk. A negatív töltést is már kitalálhattuk mitől van, méghozzá azért, mert az atom negatív töltésű részecskét vett fel, tehát túlsúlyba kerültek a pozitív töltésű részecskékhez képest.
És most nézzük meg hogy az egyszerű atomokból milyen töltésű ionok keletkeznek, főcsoport szerint:
- 1. F.Cs.: Az itt található atomok egy elektron leadásával érik el a nemesgáz szerkezetet, tehát egyszeresen pozitív töltésű /kationok/ ionok lesznek.
Pl: Na+, K+, Li+
- 2. F.Cs.: Ezen főcsoport atomjai, két elektron leadásával érik el a nemesgáz szerkezetet, vagyis, kétszeresen pozitív töltésű /kationok/ lesznek.
Pl: Ca2+, Mg2+
- 3.F.Cs.: Ezen főcsoport atomjai, három elektron leadásával érik el a nemesgáz szerkezetet, vagyis, háromszorosan pozitív töltésű /kationok/ lesznek.
Pl: Al3+
Itt jön a váltás, a további főcsoportok már elektront vesznek fel szívesebben, tehát anionok lesznek.
- 5. F.Cs.: Ezen főcsoport atomjai, három elektron felvételével érik el a nemesgáz szerkezetet, vagyis, háromszorosan negatív töltésű /anionok/ lesznek.
Pl: N3-
- 6. F.Cs.: Ezen főcsoport atomjai, kettő elektron felvételével érik el a nemesgáz szerkezetet, vagyis, kétszeresen negatív töltésű /anionok/ lesznek.
Pl: O2-
- 7. F.Cs.: Ezen főcsoport atomjai, egy elektron felvételével érik el a nemesgáz szerkezetet, vagyis, egyszeresen negatív töltésű /anionok/ lesznek.
Pl: Cl-